No Brasil, o processo de desenvolvimento dos produtos transgênicos realizados nas instituições de pesquisa e empresas do setor é regido pela Lei de Biossegurança n° 11.105 de 2005, considerada uma das mais rigorosas e completas do mundo.
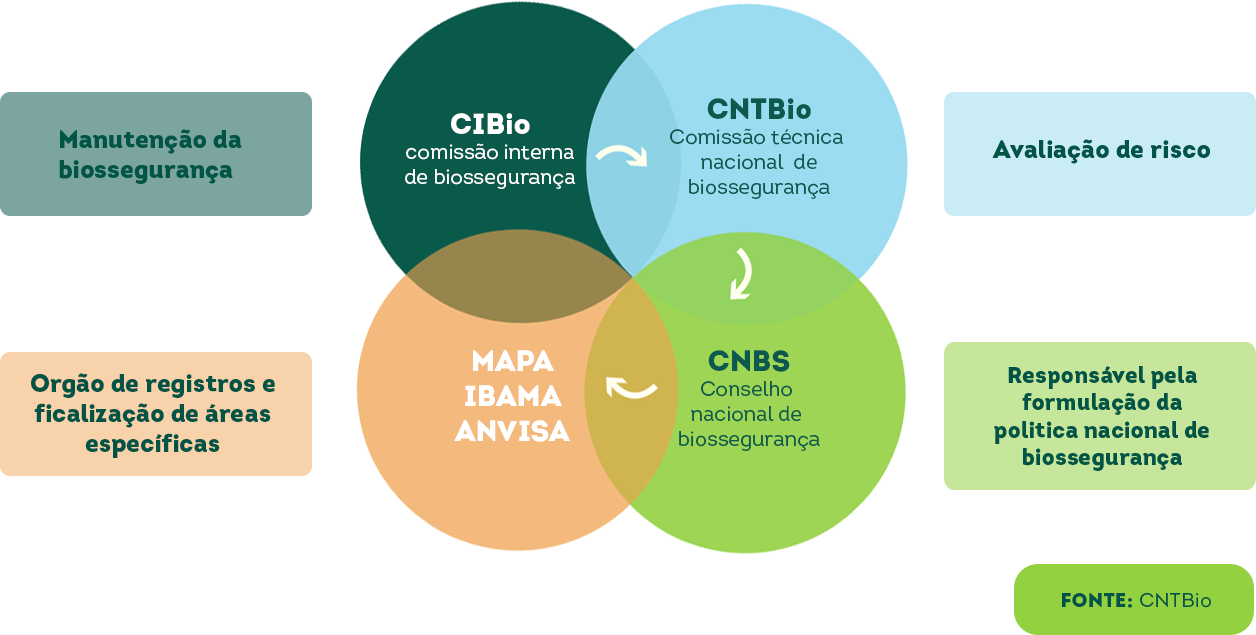
A legislação regula todas as atividades relacionadas à biotecnologia e para garantir sua segurança foi criada a Comissão Técnica Nacional de Biossegurança (CTNBio), que presta apoio técnico consultivo e de assessoramento ao Governo Federal em questões relacionadas aos Organismos Geneticamente Modificados (OGMs) e derivados. O colegiado é composto por especialistas das áreas vegetais, ambientais, de saúde humana e animal, bem como representantes dos Ministérios da Ciência, Tecnologia e Inovação; Agricultura, Pecuária e Abastecimento; Saúde; Meio Ambiente; Indústria, Comércio Exterior e Serviços; Defesa; Pesca e Aquicultura; Desenvolvimento Agrário e Agricultura Familiar; e Relações Exteriores.
A finalidade da CTNBio é prestar apoio técnico consultivo e assessoramento ao Governo Federal na formulação, atualização e implementação da Política Nacional de Biossegurança relativa a OGM, bem como no estabelecimento de normas técnicas de segurança e pareceres técnicos referentes à proteção da saúde humana, dos organismos vivos e do meio ambiente, para atividades que envolvam a construção, experimentação, cultivo, manipulação, transporte, comercialização, consumo, armazenamento, liberação e descarte de OGM e derivados;
A Lei de Biossegurança também criou o Conselho Nacional de Biossegurança (CNBS), que é um órgão de assessoramento superior da Presidência da República, constituído de 11 ministros de Estado, com o objetivo de formular e implementar a Política Nacional de Biossegurança – PNB.
A Lei de Biossegurança estabelece três diretrizes principais
- Estímulo ao avanço científico na área de biossegurança e biotecnologia;
- Proteção à vida e à saúde humana, animal e vegetal;
- Observância do princípio da precaução para a proteção do meio ambiente.
A avaliação do impacto da modificação genética no organismo receptor leva em consideração os riscos para o meio ambiente e para a saúde humana e animal e a liberação comercial de um produto geneticamente modificado (GM) só acontece após a análise de biossegurança que incluem testes toxicológicos, alergênicos, nutricionais e ambientais.
AVALIAÇÕES PARA A APROVAÇÃO REGULATÓRIA DE UMA OGM
INFORMAÇÕES SOBRE OGM
- Caracterização do gene;
- Caracterização da expressao de gene;
- Estabilidade genotipica;
- Possibilidades de mudanças genéticas;
PLANTA E MEIO AMBIENTE
- Ocorrência e histórico de uso;
- Efeitos em orgânismos indicadores;
- Dispensão propragação e reprodução de OGM;
- Sobrevivência de OGM em diferentes ambientes do ocupado pelo organismo de orgiem;
SAÚDE HUMANA E ANIMAL
- Histórico do uso;
- Efeitos da cadeia produtiva de alimentos e rações;
- Estabilidade da proteína;
- Toxicologia e farmacologia;
- Similaridade e expressao de proteinas alergênicas;

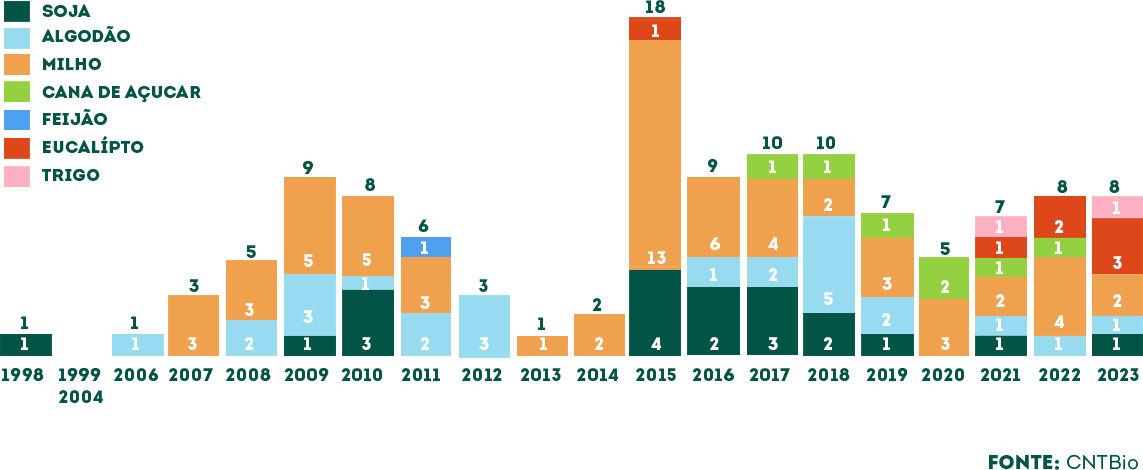
Até março de 2023, estavam aprovadas no país variedades transgênicas de soja, milho, algodão, feijão, cana-de-açúcar e eucalipto.
HISTÓRICO DE APROVAÇÕES DE OGM NO BRASIL
Desde a primeira aprovação de uma planta trangênica no Brasil, em 1998, até 2023 foram aprovados 121 plantas.
O maior destaque vai para o milho, que representou 50% do total das aprovações, seguido pelo algodão (21%) e soja (16%).
Histórico de aprovações de plantas transgênicas para comercialização no Brasil: por cultura (1998 a 2023)